简介
胃肠道间质瘤(Gastrointestinal Stromal Tumors, GIST)是一类起源于胃肠道间叶组织的肿瘤,占消化道间叶肿瘤的大部分。Mazur 等于1983 年首次提出了胃肠道间质肿瘤这个概念,GIST与胃肠道肌间神经丛周围的Cajal间质细胞(Interstitial Cells of Cajal,ICC)细胞相似,均有c-kit基因、CD117(酪氨激酶受体)、CD34(骨髓干细胞抗原)表达阳性。

临床体征
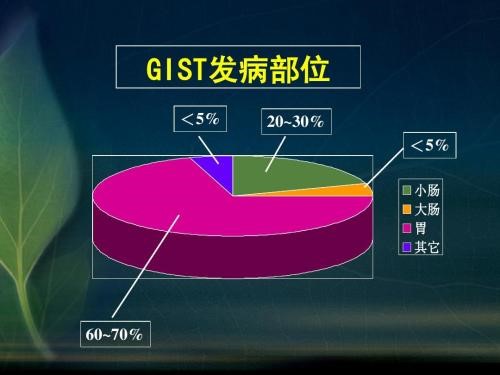
胃肠道间质瘤占胃肠道恶性肿瘤的1~3%,估计年发病率约为10-20/100万,多发于中老年患者,40岁以下患者少见,男女发病率无明显差异。GIST大部分发生于胃(50~70%)和小肠(20~30%),结直肠约占10~20%,食道占0~6%,肠系膜、网膜及腹腔后罕见。GIST病人20-30%是恶性的,第一次就诊时约有11~47%已有转移,转移主要在肝和腹腔。
疾病症状
无特异性临床表现,病程可短至数天长至20年,恶性GIST病程较短,多在数月以内,良性或早期者无症状。GIST的主要症状依赖于肿瘤的大小和位置,通常无特异性。胃肠道出血是最常见症状。贲门部GIST吞咽不适、吞咽困难症状也很常见。部分病人因溃疡穿孔就诊,可增加腹腔种植和局部复发的风险。常见症状有腹痛、包块及消化道出血及胃肠道梗阻等。腹腔播散可出现腹水,恶性GIST可有体重减轻、发热等症状。
诊断
1.体检:部分肿瘤较大的患者可触及腹部活动肿块、表面光滑、结节或分叶状。
2. 实验室检查:患者可出现贫血、低蛋白血症,大便潜血阳性。
3. 影像学特点:
3.1 胃镜及超声胃镜检查:
对于胃GIST,胃镜可帮助明确肿瘤部位及大小。超声内镜对于胃外生性肿瘤可协助诊断,协诊GIST位置、大小、起源、局部浸润状况、转移等。部分患者可获得病理学诊断。
3.2 CT 检查:
CT 平扫发现肿瘤多呈圆形或类圆形, 少数呈不规则形。良性肿瘤多小于5cm ,密度均匀,边缘锐利,极少侵犯邻近器官,可以有钙化表现。恶性肿瘤多大于6cm,边界不清,与邻近器官粘连,可呈分叶状,密度不均匀,中央极易出现坏死、囊变和出血, 肿瘤可出现高、低密度混杂, 钙化很少见。增强CT 可见均匀等密度者多呈均匀中度或明显强化,螺旋CT 尤以静脉期显示明显。这种强化方式多见于低度恶性胃肠道间质肿瘤,坏死、囊变者常表现肿瘤周边强化明显。CT消化道三维重建对于肿瘤可协助诊断,协诊GIST位置、大小、局部浸润状况、转移等。
3.3 18FDG-PET和18FDG-PET/CT:
CT,MRI等影像学方法只是评估肿瘤的大小,肿瘤的密度以及肿瘤内的血管分布,不能反应肿瘤的代谢情况,用18氟脱氧葡萄糖的PET检查可以弥补以上物理学检查的不足,它的原理是胃肠道间质肿瘤是一种高代谢的肿瘤,利用肿瘤内强烈的糖酵解反应摄取高密度的18氟脱氧葡萄糖跟踪显影,对早期转移或者复发比CT敏感,并且在评估肿瘤对化疗药物的反应时明显优于其它物理学检查方法, PET与CT联合扫描方法能同时评估肿瘤的解剖和代谢情况,对肿瘤的分期以及治疗效果的评估优于CT,也为其它实体肿瘤分子靶向治疗的疗效判断提供了一个参考。
3.4 其他辅助检查:
X线钡餐示边缘整齐、园形充盈缺损,中央可有“脐样”溃疡龛影,或表现为受压、移位。肠系膜上动脉DSA对于小肠GIST诊断、肿瘤定位具有重要意义。
病因及常见疾病
GIST是消化道最常见的间叶源性肿瘤,可以发生在胃、小肠、食管、结直肠以及肠系膜、肝等部位免疫学以DOG1、CDll7、CD34阳性为主,c-kit或PDGFRA基因功能获得性突变是重要的分子特征。
临床表现
胃肠间质瘤在临床上发病率是相对少见,主要会发生在肠壁外肠系膜,胃肠间质细胞这些地方,他的临床表现有的时候就是一个腹腔的肿瘤,查胃镜时候会在胃镜图像上看到,描述形状上各方面都不限癌症的典型特征,表面很光滑,没有很倾斜的特点,胃肠间质瘤会转移和复发,所以专门单独列出来做一个肿瘤。
治疗原则
手术治疗
手术切除:是胃肠道间质肿瘤首选且唯一可能治愈的方法,可行局部切除或行楔形切除,切缘距肿瘤边缘应超过2cm以上。GIST高危患者术后复发转移率高,可达55%~90%,80%在术后1~2年内有3/4局部复发,半数还同时出现肝转移,虽有可能再切除,但难以提高生存率,原发灶切除彻底无转移灶者5年生存率54%(50%~65%),不能彻底切除或转移者5年总生存期<35%,不能切除者总生存期 9~12月。
药物治疗
复发/合并转移胃肠道间质肿瘤的治疗:
伊马替尼作为选择性kit/PDGFRA受体酪氨酸激酶抑制剂,应用于手术不可切除及转移性病例的治疗以及部分高度侵袭危险性病例的术后预防性化疗,使GIST的治疗发生了革命性的进步。手术切除后复发表现为:原发手术切除部位的新病变,原发病灶以外的部位出现转移灶,现存肿瘤体积的增大以及在接受伊马替尼治疗的病人病灶中出现结节性高密度影。复发或者转移的病人的手术预后与肿瘤分期,肿瘤风险评估以及首次手术后无瘤生存的时间有关,DeMatteo等在200例术后复发的病人中研究表明,完整切除复发的转移灶的病人的中位生存率是54个月,而不完整切除转移灶或者是有残余伴随病灶的中位生存率下降到5个月[7]。不能手术切除的先行伊马替尼治疗4-12个月,在达到药物最大疗效及早行手术治疗,手术后继续伊马替尼的药物治疗,手术联合靶向分子药物的综合治疗方法明显的改善了胃肠道间质肿瘤患者的预后。
伊马替尼耐药的胃肠道间质肿瘤药物治疗:
伊马替尼的耐药发生率据统计可高达63%,10-30%的胃肠道间质肿瘤表现出原发性耐药。原发性耐药的定义是用药6个月后肿瘤继续进展,这种进展往往是多灶性病变,这些耐药的GIST表达野生型的KIT或者Kit的外显子9的突变或者是PDGFRAD843V突变。继发型耐药的定义是用药6个月后再发的耐药,继发性耐药的两个可能的机制是:首先,突变稳定了KIT激酶的结构阻止了KIT与伊马替尼的结合,其次,突变干扰了伊马替尼与KIT结合,继发耐药胃肠道间质肿瘤往往表现出外显子11原发的突变,其次的突变部位是外显子12,14,17,最近的研究表明原发的外显子12K643E和外显子14T670I突变与继发耐药有关,而舒尼替尼是一种经口给药的能够抑制多种受体酪氨酸激酶活性的有效药物,舒尼替尼治疗靶点包括:VEGFR1-3,CD117,KIT,PDGFRA和PDGFRb,作用谱广,抑制VEGFR2和PDGFR-A的作用比其它药物高10-30倍,并且可以抑制对伊马替尼耐药的突变类型,目前很多临床研究结果表明舒尼替尼可以作为伊马替尼耐药的一线替代药物。