肿瘤并非“单打独斗”,它们的发生、生长及转移与周围环境息息相关。不仅与肿瘤细胞自身的(核和胞质)内在环境有关,还与肿瘤的周围组织、细胞、多种细胞外基质、分泌因子构成的外部环境有关。那么肿瘤的转移、缺氧是怎么一回事呢?日前,广州复大肿瘤医院徐克成总院长就在“复大新视野 徐克成大讲堂”上分享这一内容,让我们去了解一下吧。

01 癌症是如何转移?
癌细胞是正常的细胞由于物理、化学、病毒等致癌因子导致的原癌基因和抑癌基因突变所转变而成的。癌症发生转移是引发癌症患者死亡的首要原因,这会涉及到癌组织与其微环境的相互作用。
癌细胞首先破坏基底膜(BM)的完整性,逃离原发肿瘤,侵入周围的细胞外基质(ECM),进入循环系统;然后以循环肿瘤细胞(CTC)的身份生存,再变成播散性肿瘤细胞(DTC)侵入并定居远隔组织,最后获得脉管系统支持,实现异位生长。 这一过程不断重复,引起新的愈来愈多的转移,波及全身。
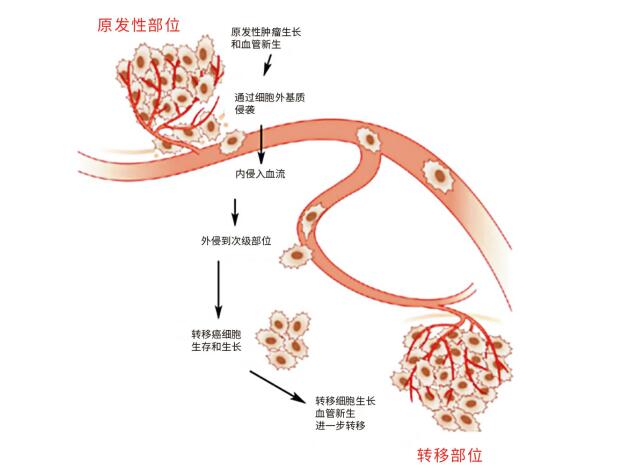
在此过程中,肿瘤快节奏的生长需要改变其新陈代谢。同时,新形成的肿瘤血管功能失调,不能有效供应氧气,造成肿瘤缺氧,引起的肿瘤细胞能量代谢的重编程,是癌症的重要特征,也是癌症转移发生的动力和基础。
02 肿瘤缺氧如何促进转移?
低氧环境是一个重要的微环境因子,它会促进肿瘤转移发生。在临床上,肿瘤组织通过缺氧诱导因子(HIF)的激活而适应环境变化,进而上调与血管生成、代谢调节、pH平衡和细胞凋亡相关的多个基因的表达,促进肿瘤存活,导致放射疗法、化学疗法(CT)和免疫疗法产生耐药性。
缺氧直接导致癌症的恶性特性。肿瘤微环境中缺氧促进癌细胞成簇或成群集体迁移,是帮助癌细胞转移成功的罪魁祸首。
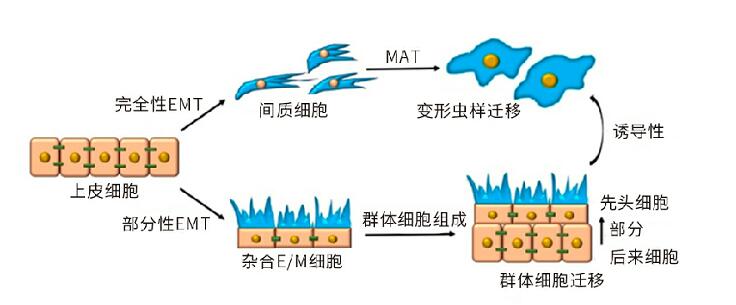
▲缺氧会发生上皮-间质转化(EMT)诱导,增强迁移能力
缺氧促进癌细胞侵袭。缺氧性肿瘤细胞不仅出现于原发瘤的中心部,而且在肿瘤侵袭性前沿,提示肿瘤缺氧的动态本质。缺氧调节通过基因上调,促进癌细胞增殖、血管新生、ECM重塑以及转移的各个步骤。
另外,在氧压正常时,HIF1-α羟基化,被蛋白酶降解,但在缺氧状态下,该因子甚稳定,与HIF1-β形成复合物,被激活,再结合各种辅因子,靶向各种特殊基因,促进细胞自噬,增加肿瘤的侵袭性。
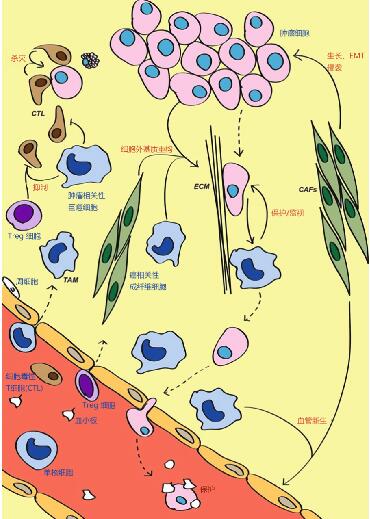
缺氧促进肿瘤细胞外渗。作为远距离定居的第一步,循环系统的肿瘤细胞(CTC)首先停止循环,然后外渗以离开血管。通过细胞阻滞外渗、辅助性外渗、机械性阻滞外渗或管腔内增生等外渗方式,破裂并溢出至继发部位。
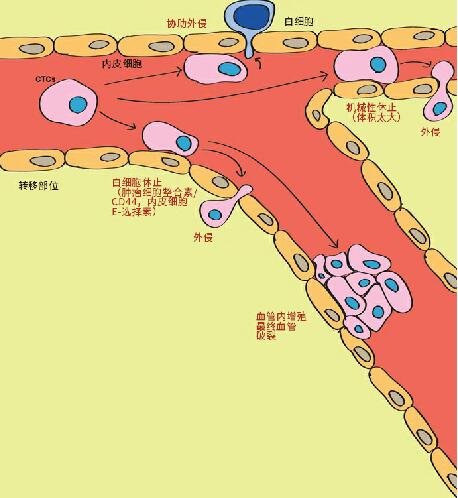
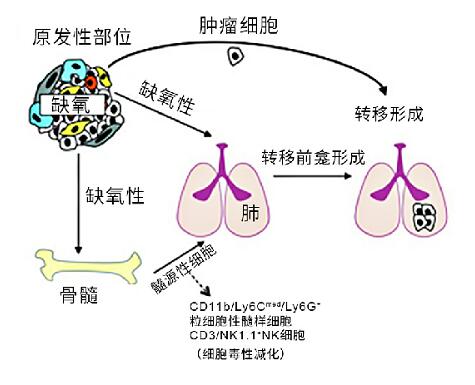
缺氧促进转移前龛形成。转移前龛的形成为远处转移提供准备,在此募集了宿主骨髓衍生细胞(BMDC),并对其微环境进行修饰,从而准备位点,以备转移来的癌细胞定殖和生长。通俗地说,就是给从原发灶转移来的癌细胞提前“筑巢”。转移前龛的存在极大地增强了肿瘤细胞在次级部位的定植成功,并且可以影响转移扩散的途径。
缺氧是阻止癌症有效免疫治疗的重要因素。缺氧补偿减少了肿瘤细胞、免疫抑制细胞和内皮细胞上的免疫检查点配体(PD-L1和PD-L2)的表达,允许免疫细胞渗出正常化的血管壁,与肿瘤细胞相遇,并发挥其细胞毒性作用。
03 如何改善肿瘤缺氧?
纠正肿瘤缺氧的策略和方法:包括靶向HIFs和重编程代谢分子,可采用HIF抑制剂、pH的调节剂;增进氧供应,可采用高压氧(HBO)、变构血红蛋白修饰剂;促进氧扩散分子和氧气转运,可采用血红蛋白制剂、含氟化合物(FCs)、氦气或氢气;减少O2消耗,可采用二甲双胍。此外,改善肿瘤微环境也可以纠正肿瘤缺氧,通过以下方式:(1)诱导肿瘤血管正常化,已知有三种方法即抗血管生成、氯喹和肌醇三焦磷酸盐;(2)降低实质压力,减轻肿瘤血管受压,可以采用基质耗竭剂,例如抗纤维化和基质消耗药物、化疗药物例如紫杉醇直接靶向基质的药物,例如聚乙二醇化透明质酸酶(PEGPH20)、血管性药物,例如血管紧张素受体阻滞剂氯沙坦(Losartan)。临床II/III期氯沙坦治疗局部胰腺癌,已显示令人鼓舞的效果。