广州复大肿瘤医院 徐克成
摘要:进展性或转移性胰腺癌患者预后恶劣。化疗是目前主要治疗方法。但无论是吉西他滨单用还是与其他药物联合应用,均不能有效延长患者生存期。以冷冻消融为主的综合治疗,可以延长进展性或转移性胰腺癌患者生存期。这一结果提示,采用将经皮冷冻(C)(125碘粒子植入)、肿瘤血管(微血管)介入(C)和联合免疫治疗(C)组合起来,个体化应用(P),形成“3C+P模式”,可作为治疗进展性肿瘤的新策略。
The management strategy of advanced cancer from pancreatic cancer treatment
XU Kecheng Fuda Cancer Hospital Jinan University School of Medicine, Guangzhou, China
Abstract:Advanced or metastatic pancreatic cancer has poor prognosis. Chemotherapy is current option of the treatment. However, gemcitabine alone or its combination with other drugs are not possible to improvement of patient~s survival. The comprehensive therapy including cryoablation may prolong the survival of patients with advanced or metastatic pancreatic cancer, that suggests that combination of percutaneous cryoablation (C)(125iodine seed implantation), cancer microvascular intervention(C) and combined immunotherapy(C) and their personalized use(P), forming called “3C+P model”, can be a novel strategy for the treatment of advanced cancer.
1 化疗不能有效延长胰腺癌患者生存期
胰腺癌的治疗迄今仍是一巨大挑战。大多数胰腺癌在获得诊断时已是局部进展性或转移性。转移性胰腺癌患者1年生存率低于20%,5年生存率少于5%【1】。治疗主要采用化疗。1996年Rosenberg 等【2】报告吉西他滨对转移性胰腺癌的疗效。63例患者中17例(27%)获得临床反应,临床受益的中位时间为14周,患者中位生存期3.85月(0.3-18月)。其后吉西他滨被作为进展性胰腺癌治疗标准药物。但进一步研究发现其延长患者生存期的效果与5FU无明显差异。2010年Stathin等【3】报道单用5-FU或吉西他滨治疗的进展期胰腺癌患者,中位生存期分别为4.41和5.65月。
为改善IV期胰腺癌患者生存期,常联合应用化疗药物,但统计学处理未显示其优越性。Xenidis等【4】最近报告40例初治转移性胰腺癌接受吉西他滨、泰索帝(Docetaxel)和capecitabine,中位无进展生存期6个月。放化疗联合应用也不能改善转归,中位生存期在吉西他滨治疗组和联合放/化疗组分别仅为7.8和2.4个月【5,6】。
近年来,一些分子靶向药物与吉西他滨联合应用试用于进展期胰腺癌治疗。在联合应用的药物中,EGFR拮抗剂erlotinib曾被认为是最有希望的药物,但进一步研究发现其改善生存期有限(中位生存期6.24月,单用吉西他滨组5.91月)【7】。吉西他滨联合cetuximab的结果相似,III期研究显示中位生存期在联合组6.3 月,与单用吉西他滨组的 5.9 月无差异(P = 0.23)【8】。由于这种联合用药毒性加大,目前已趋放弃进一步试验。
目前认为,胰腺癌细胞对化疗药物和放射呈现抵抗。对于进展期或转移性胰腺癌患者,无论是单药还是多种药物联合应用,包括与分子靶向药物联合应用,以及放化疗联合应用,均不能有效延长患者生存期,寻找新的治疗极为必要【9-12】。
2 我们的尝试
2001年,奥地利Korpan【13】在他主编的《Basic of Cryosurgery》声称:监于胰腺癌手术切除率很低,而冷冻治疗的并发症发生率和死亡率均很低,建议大多数病例用冷冻代替常规治疗。他认为,冷冻治疗胰腺癌几无禁忌证。
自2001年,我们应用应用氩氦冷冻系统治疗不能手术切除胰腺癌进行冷冻消融治疗。初期在手术中直视下冷冻,后在CT或CT-超声联合引导下经皮冷冻;进而,作冷冻-125碘粒子经皮植入(近距离照射)联合治疗;对于估计消融不完全,或有局部转移患者,给予血管介入治疗(区域性化疗、微血管介入治疗);同时,给予全身性联合免疫治疗(combined immunotherapy for cancer,CIC),给予细胞因子激活的杀伤细胞(CIK)和树突状细胞疫苗(DC),或/和T细胞治疗,以及非特异性细胞因子注射等治疗。以下列举我们的4份研究结果:
(1)2008年,我们报告49例冷冻加上125碘粒子植入治疗49例局部进展性胰腺癌的结果【14】。49例中,13例接受手术中冷冻,36例接受经皮冷冻。在接受经皮冷冻的患者中,17例接受了第2次冷冻,3例共接受3次冷冻。碘粒子于35例在冷冻的同时植入,14例在冷冻后3-9天植入。术后3个月内作CT评价肿瘤反应,结果显示完全反应(CR)、部分反应(PR)、稳定(SD)和进展(PD)分别为20.4%、38.8%、30.6%和10.2%(图1-5)。中位随访期18个月(5-40月)。中位生存期16.2月。26例(53.1%)生存12个月或更长,其中1例生存54个月,最后死于原发性肺癌。至死胰腺肿瘤未复发(见图1)。36例在随访期死亡,其中17例死于癌播散,11例死于肝转移伴肝衰竭,5例死于心脑疾病。1、2和3年生存率分别为63.1%、22.8%和9.5%。
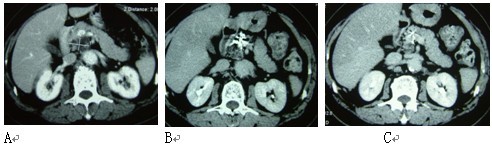
图1 男性,80岁。胰腺沟突部腺癌。A:治疗前,B:冷冻加碘粒子植入后3个月复查,C:治疗后12个月复查。
患者活存54个月,死于二重癌肺癌。
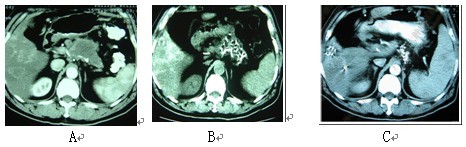
图2 男性,61岁。胰腺体尾部腺癌伴肝转移。A:治疗前;B:冷冻-碘粒子联合治疗后1个月复查;
C::治疗后6个月复查。血液CA19-9降至40IU以下。患者生存27个月。
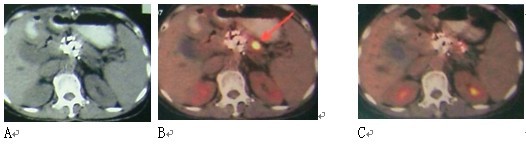
图3 女性,59岁。胰腺头部4X4 cm病变,活检显示未分化腺癌。A:治疗前;B:冷冻-碘粒子治疗后12个月复查PET-CT,原先病变无明显活性,但在胰腺体部出现新病变,给予冷冻治疗;C:3个月后复查PET-CT,病变活性抑制。患者生存28个月。
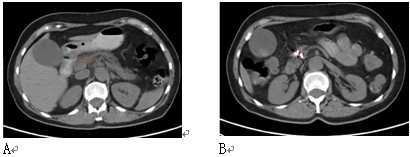
图4 女性,61岁。胰腺颈部3X3cm病变,活检显示腺癌。肝内有3个转移灶(图中未显示)。A:治疗前;B:冷冻加125碘粒子植入治疗,7个月后复查,胰腺和肝内无明显癌肿证据(肝内病变未显示)。患者迄今已生存4年。
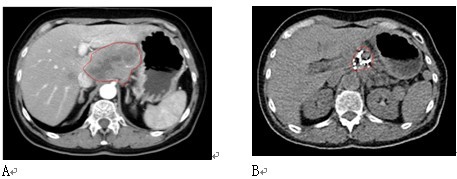
图5 女性,64岁。胰腺头部肿块,活检显示鳞癌。给予冷冻加碘粒子植入。A:治疗前;B:治疗后8个月复查。患者生存14个月。
(2)2008年9月至2009年,我们对59例IIIb或IV期胰腺癌做了前瞻性观察【15】。所有病例均接受过吉西他滨或5FU为主的化疗而无反应。共有76个活检证实的肿瘤。中位肿瘤大小4.5cm。全部接受以经皮冷冻为主的综合治疗。无冷冻相关性死亡发生。中位随访期7.5月(3-14月)。肿瘤无完全反应,部分反应38.8%,稳定54.2%,进展32.2%。3、6和12个月生存率分别为89.7%,、61.1% 和 34.5 %,其中40例无肝转移者的生存率分别为92.4%、84.2%和 62.1%,在19例伴肝转移分别为59.3%、43.2%和13.7%。无肝转移者1年生存率与上述报告【14】相似。
(3)回顾分析2009年1月至2010年2月32例胰腺癌经皮冷冻治疗效果【16】。32例中,II、III和IV期分别为3、11和18例。病变于13例在胰头,19例在胰体和/或尾部。肿瘤大小平均5.2+/-8cm。共作49次冷冻。27例疼痛积分减少≥50%,22例止痛药用量减少50%,16例KPS积分增加20。PR和SD分别见于9和21例。平均和中位生存期分别为15.9和12.6月。6、12和24月生存率分别为82.8%, 54.7% 和 27.3%。
(4)对2008年10月至2010年8月住院的145例IV期胰腺癌患者的治疗结果做了回顾性分析【17】,结果显示①胰腺内肿瘤和胰腺外转移灶同时接受冷冻加125碘粒子植入组(“根治”组)中位生存期8个月,长于胰腺内接受粒子植入而胰外病变接受冷冻加粒子植入组(“姑息”组)的4个月 (P < 0.001);②在“根治”组,诊断后2-14个月内接受治疗者(“延迟”治疗)生存期长于2个月内接受治疗(“即时”治疗)者(13对6个月)(P = 0.0034),在“姑息”组也显示类似结果(5对3个月,P = 0.0415);③在“根治”组,多次治疗者生存期长于单次治疗者(11对7个月,(P = 0.0389),但在“姑息”组无此现象(P = 0.99)。在诊断后2-14个月接受治疗者生存期较长,可能与这些患者预先接受化疗有关。
(5)对2008年11月至2012年7月住院的转移性胰腺癌患者共106例,分析了免疫治疗对治疗转归的影响【18】。106例分为4组:冷冻-免疫联合治疗组(31例),36例仅接受单纯冷冻治疗组(36例)、单纯免疫治疗组(17例)和单纯化疗组(22例),中位生存期分别为13、7、5和3.5月。在联合治疗和单纯冷冻组,多次冷冻的患者中位生存期长于单次冷冻者(P = 0.0048 and 0.041),治疗前免疫功能正常者生存期又长于免疫功能异常者(P < 0.0001和P = 0.0004)
综上所述,经皮冷冻,或联合125碘粒子植入治疗,能给进展性或转移性胰腺癌患者带来较好的生存受益;多次治疗、冷冻联合全身性免疫治疗能取得更好效果。
3 进展期癌症治疗策略探讨
我们治疗进展期胰腺癌的实践,虽然是初步的,但提示对于进展期或转移性肿瘤,单纯化疗是不够的,在大多数情况下,化疗不可能延长患者生存期。
近年来提出化疗可能具有“反作用”(opposite effect),使癌细胞活性增强,促进癌肿转移。Yamauchi等【19】观察给裸鼠的上腹部静脉内注射人纤维肉瘤细胞的反应,发现在注射前24小时给予环磷酰胺鼠,这些细胞在血管内大量增值,并从血管内外渗和定居,而在未给予环磷酰胺鼠,瘤细胞在血管内较长时间处于静止状态。这一研究提示化疗药可产生“反作用”。美国Vanderbilt-Ingram 癌症中心研究组认为目前的抗癌治疗仅有部分或完全没有作用,甚至治疗后肿瘤加速发展。他们发现,移植性乳腺癌鼠在给予化疗药(表阿霉素、泰索帝 (Taxotere))后,血液和肿瘤内β肿瘤生长因子(TGF)水平升高,血液中癌细胞数增加,癌转移增多。认为βTGF是关键因子,这种因子能增加体内调节性细胞增生,抑制免疫功能,使抗癌治疗作用减弱。他们在乳腺癌患者也发现类似现象【20】。
现认为肿瘤干细胞的存在是肿瘤发生和复发的根源。在肿瘤放疗和化疗中,普通的肿瘤细胞对治疗是敏感的,容易被消灭,但肿瘤干细胞却具有很强耐受力,不容易被摧毁,如同“种子细胞”,会继续产生新的肿瘤细胞【21,22】。DNA损伤所引起的基因组不稳定性,可以导致普通肿瘤细胞变成干细胞样肿瘤细胞。化疗药,作为DNA损伤剂,有可能一方面消灭肿瘤细胞,另一方面,也可能加剧基因组不稳定性,诱导普通肿瘤细胞演变成干细胞样肿瘤细胞。目前尚无有效的化疗药物(和放疗)能杀灭癌干细胞。化疗后,肿瘤可以缩小甚至“消失”,在判断治疗反应时评定为“部分反应”(PR)或“完全反应”(CR),但癌干细胞没有被消灭,复发仍随时可以发生。不仅原先存在的癌干细胞不能被化疗药物消除,在物理的(放疗)和化学的(化疗)的作用下,一般的癌细胞会变成干细胞样癌细胞【23】。这可能是化疗“反作用”的机制。
对进展期肿瘤的治疗,应从局部和全身两方面入手。局部治疗主要采用消融技术,如射频【24】、微波【25】、超声聚焦【26】、不可逆性电穿孔【27】和冷冻【28】。与其他技术比较,冷冻消融(cryoablation,CRA)具有以下优点【28】:①可消融小的肿瘤,也可消融大的肿瘤(≥5cm),至少可以减瘤容量;②对于临近大血管的肿瘤,冷冻一般不会损伤大血管;③易于在超声引导下进行;④冷冻后肿瘤组织抗原(蛋白质形式)释放或暴露,可激发机体抗肿瘤免疫,是为“冷免疫”;⑤有证据表明冷冻后癌组织对化疗/放疗敏感性增加【29】。
对于较大的肿瘤,特别是临近大血管者,冷冻区边缘肿瘤细胞死亡常不完全,在此区域植入125碘粒子,可实施“近距离治疗”,与冷冻有相辅相成之用。
在冷冻治疗前后,作血管介入区域性化疗,适用于肿瘤较大,伴多发性转移者。我们采用特殊技术,将远比一般化疗剂量为少的药物配置成≤100nm的微颗粒,通过微导管输入肿瘤血管。微颗粒通过泄漏的肿瘤血管大量聚集于瘤灶内,以致肿瘤内化疗药物浓度高,瘤内微血管被栓塞,但由于微颗粒不能透过正常血管,因此不会导致严重副作用。我们将此种血管介入成为“肿瘤微血管介入”(cancer microvascular intervention,CMI)。实验显示,此法中应用的化疗药仅为常规化疗的1/10,但肿瘤内药物集聚量是常规化疗的40-50倍。在冷冻和/或碘粒子植入后仍残留病变者,给予CMI可使病变内血管迅速消失,从而强化消融效果(图6 )。
免疫治疗是一种全身性治疗。近几十年来,肿瘤免疫治疗几经沉浮【30】。让世界对癌症免疫治疗重新发生兴趣的是2008年发表在《新英格兰医学杂志》上一篇文章。Hunder等【31】报告一名52岁男性患者,患复发性黑色素瘤伴右肺和胸膜、左髂窝和腹股沟区多发性转移,已接受化疗、大剂量白介素2和干扰素治疗,均无效。经自体抗黑色素瘤相关抗原CD4+T细胞回输治疗后,肺部和盆腔转移性病变全部消失。到作者报道这篇文章时,患者已无病生存26个月。此后的研究证明,CIK、DC和T细胞有抗癌作用。免疫治疗联合化疗已在临床上用于转移性胰腺癌治疗,显示能改善生存率【32】。
我们对进展性治疗患者,在冷冻治疗后予以免疫治疗,显示能延长患者生存期。这一程序性安排在理论上是合理的。冷冻消融后,肿瘤抗原暴露和释放,此时DC回输的DC或T细胞可被抗原激发。因此我们一般在冷冻后3天内给予DC-CIK或/和T细胞回输。
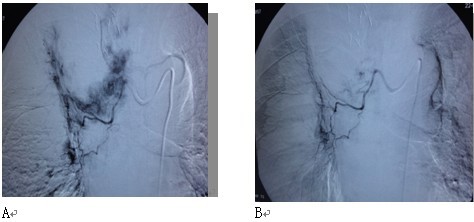
图6 微血管介入与冷冻、碘粒子植入的相辅相成作用。 图示左肺癌,冷冻加125碘粒子植入一周,血管造影在肿瘤周边区仍有肿瘤血管染色(A),通过微导管注入微颗粒化疗药(CMI),原先血管染色大部消失
将冷冻消融(CRA)(加125碘粒子植入)-肿瘤微血管介入(CMI)和联合肿瘤免疫疗法(CIC)相结合,以发挥相辅相成作用,看来应作为治疗进展性肿瘤,让患者长期生存的重要策略(图7)。化疗和放疗仅用于没有接受过此类治疗,预期癌细胞对其较敏感者。我们将这一系列的治疗成功地组合起来,按照患者情况个体化选择应用(personalization,P),形成所谓“3C+P”治疗模式” (3C therapy model)。
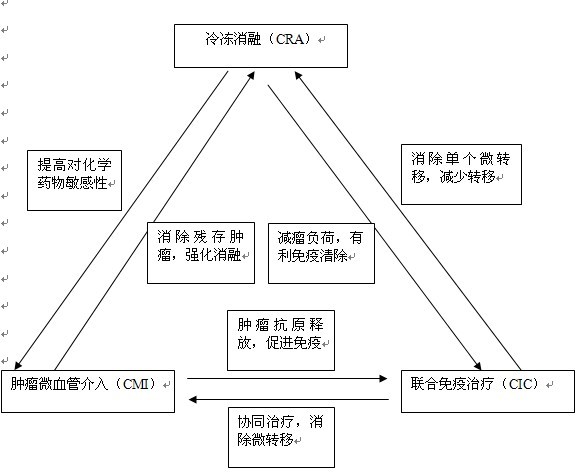
图7 3C+P肿瘤治疗模式(P:个体化应用)
2012年5月,我们曾对2007年以前在我院接受3C+P治疗,并符合下列条件的患者做了随访:①诊断经过病理学检查证实者,②经过综合评价,不能手术治疗者,③做过放化疗而失败者,④肿瘤复发伴有重要器官转移者;⑤预期生存期不超过12个月者。共有145例接受随访。结果如表2。胰腺癌10例,生存1、2、3、4和5年的分别有4、2、1、1、1例,最长1例已生存6年,5年生存率10%;肺癌98例,7例生存5年以上,1例已生存10年,5年生存率7%;肝癌37例,8例生存5年以上,2例已生存10年,5年生存率22%。
上述观察和看法,显然是初步的,但结果提示“3C+P模式”可作为治疗进展性肿瘤的新策略,对此值得进一步探讨。
表1 145例进展性肿瘤患者随访结果
|
生存期
|
肺癌(98例)
|
肝癌(37例)
|
胰腺癌(10)
|
合计(145例)
|
|
1年
|
37
|
23
|
4
|
64
|
|
2年
|
15
|
20
|
2
|
37
|
|
3年
|
11
|
12
|
1
|
24
|
|
4年
|
10
|
12
|
1
|
23
|
|
5年
|
7
|
8
|
1
|
16
|
|
6年
|
5
|
3
|
1
|
9
|
|
7年
|
2
|
3
|
0
|
6
|
|
10年
|
1
|
2
|
0
|
3
|
参考文献:
【1】 Jemal A., Bray F., Center M.,et al. (2011) Global cancer statistics[J]. CA Cancer J Clin 2011,61: 69–90.
【2】Rothenberg ML, Moore MJ, Cripps MC,et al.A phase II trial of gemcitabine in patients with 5-FU-refractory pancreas cancer[J]. Ann Oncol. 1996,7(4):347-353.
【3】Stathis A, Moore MJ. Advanced pancreatic carcinoma: current treatment and future challenges[J]. Nat Rev Clin Oncol 2010, 7: 163-172
【4】Xenidis N, Chelis L, Amarantidis K,et al. Docetaxel plus gemcitabine in combination with capecitabine as treatment for inoperable pancreatic cancer: a phase II study[J]. Cancer Chemother Pharmacol. 2012,69(2):477-484.
【5】Chauffert B, Mornex F, Bonnetain F,et al. Phase III trial comparing intensive induction chemoradiotherapy (60 Gy, infusional 5-FU and intermittent cisplatin) followed by maintenance gemcitabine with gemcitabine alone for locally advanced unresectable pancreatic cancer: definitive results of the 2000-01 FFCD/SFRO study[J].Ann Oncol 2008,19:1592-1599.
【6】Sultana A, Tudur Smith C, Cunningham D, et al. Systematic review, including meta-analyses, on the management of locally advanced pancreatic cancer using radiation/combined modality therapy[J]. Br J Cancer 2007, 96:1183-1190.
【7】Moore MJ, Goldstein D, Hamm J, et al. Erlotinib plus gemcitabine compared with gemcitabine alone in patients with advanced pancreatic cancer: a phase III trial of the national cancer institute of Canada clinical trials group[J]. J Clin Oncol 2007,25(15):1960–1966.
【8】Chiu J, Yau T.Metastatic pancreatic cancer: are we making progress in treatment?[J] Gastroenterol Res Pract 2012:898931.
【9】Heinemann V, Boeck S, Hinke A,et al. Meta-analysis of randomized trials: evaluation of benefit from gemcitabine-based combination chemotherapy applied in advanced pancreatic cancer[J]. BMC Cancer 2008,8: 82
【10】Colucci G, Giuliani F, Gebbia V, et al. Gemcitabine alone or with cisplatin for the treatment of patients with locally advanced and/or metastatic pancreatic carcinoma: a prospective, randomized phase III study of the Gruppo Oncologia dell~Italia Meridionale[J]. Cancer 2002,94: 902-910
【11】Scheithauer W, Schüll B, Ulrich-Pur H,et al. Biweekly high-dose gemcitabine alone or in combination with capecitabine in patients with metastatic pancreatic adenocarcinoma: a randomized phase II trial[J]. Ann Oncol 2003,14: 97-104
【12】Oettle H, Richards D, Ramanathan RK,et al. A phase III trial of pemetrexed plus gemcitabine versus gemcitabine in patients with unresectable or metastatic pancreatic cancer[J]. Ann Oncol 2005,16: 1639-1645
【13】Korpan NN. Pancreas cryosurgery. In: Korpan NN. Basics of Cryosurgery[M]. Wein NewYork: Springer-Verlag, 2001: 151-154
【14】Xu KC, Niu LZ, Hu YZ,et al. A pilot study on combination of cryosurgery and 125iodine seed implantation for treatment of locally advanced pancreatic cancer[J]. World J Gastroenterol 2008,14(10): 1603-1611
【15】Niu LZ, Li H, Hu Y, et al. A novel cutaneous approach to deliver cryotherapy for the treatment of advanced pancreatic cancer. DDW 2010 USA
【16】Niu LZ, He LH, Liang Zhou L,et al.Percutaneous ultrasonography and computed tomography guided pancreatic cryoablation: Feasibility and safety assessment[J]. Cryobiology 2012,65:301–307
【17】Chen JB, Li JL, He LH,et al. Radical treatment of stage Ⅳ pancreatic cancer by the combination of cryosurgery and iodine-125 seed implantation[J]. World J Gastroenterol 2012,18(47): 7056-7062
【18】Niu LZ, Chen JB,Xu KC,et al.Combination treatment with comprehensive cryoablation and immunotherapy in metastatic pancreatic cancer[J]. Pancreas 2013 in press
【19】Yamauchi K, Yang M, Hayashi K, et al.Induction of cancer metastasis by cyclophosphamide pretreatment of host mice: an opposite effect of chemotherapy[J]. Cancer Res. 2008,68(2):516-520.
【20】Biswas S, Guix M, Rinehart C,et al.Inhibition of TGF-beta with neutralizing antibodies prevents radiation-induced acceleration of metastatic cancer progression[J]. J Clin Invest. 2007;117(5):1305-1313.
【21】Reya T, Morrison SJ, Clarke MF, et al. Stem cells, cancer, and cancer stem cells[J]. Nature 2001,414:105-111
【22】Gisselsson D. Cancer stem cells: Differentiation block or developmental back-tracking?[J]Semin Cancer Biol 2007,17:189–190
【23】Liang Y, Zhong Z, Huang Y,et al. Stem-like cancer cells are inducible by increasing genomic instability in cancer cells[J]. J Biol Chem. 2010,285(7):4931-4940.
【24】Arcidiacono PG, Carrara S, Reni M, et al. Feasibility and safety of EUS-guided cryothermal ablation in patients with locally advanced pancreatic cancer[J]. Gastrointest Endosc 2012,76(6):1142-1151.
【25】Lu Q, Cao W, Huang L,et al.CT-guided percutaneous microwave ablation of pulmonary malignancies: Results in 69 cases[J]. World J Surg Oncol 2012,10:80.
【26】Li PZ, Zhu SH, He W,et al.High-intensity focused ultrasound treatment for patients with unresectable pancreatic cancer[J]. Hepatobiliar Pancreat Dis Int 2012,11(6):655-60.
【27】Martin RC 2nd, McFarland K, Ellis S,et al. Irreversible electroporation therapy in the management of locally advanced pancreatic adenocarcinoma[J].J Am Coll Surg 2012,215(3):361-369.
【28】Xu KC,Chiu D, Shiu CTW. Overview of cryosurgery for tumors.in :Xu KC, Kopper N,Niu LZ.eds. Modern Cryosurgery for Cancer[M]. Singapore: World Sci,2012:103-122
【29】Xu KQ,Hu Y,Xu KC. Intraactional effect of cryosurgery and chemotherapy.in:Xu KC, Kopper N,Niu LZ.eds. Modern Cryosurgery for Cancer[M]. Singapore:World Sci,2012:293-306.
【30】Mellman I, Coukos G and Dranoff G.Cancer immunotherapy comes of age[J]. Nature 2011,480: 479-489
【31】Hunder NN,Wallen H,Cao J,et al.Treatment of Metastatic Melanoma with Autologous CD4+ T Cells against NY-ESO-1[J].New Engl J Med 2008;358:2698
【32】Kimura Y, Tsukada J, Tomoda T,et al.Clinical and immunologic evaluation of dendritic cell-based immunotherapy in combination with gemcitabine and/or S-1 in patients with advanced pancreatic carcinoma[J].Pancreas. 2012,41(2):195-205.